
巧用氢氧化铝电离
氢氧化铝是白色胶状物,在溶液中存在着如下平衡式:
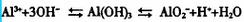
淄博氢氧化铝生产厂家介绍到在众多金属元素中由于铝是常用金属且有自身的特殊性质,但是由于铝及其氧化物、氢氧化物具有两性,相互之间反应复杂。现淄博氢氧化铝生产厂家介绍到通过运用上述公式可解决以下问题:
一、氢氧化铝离子共存判断
从上式看出,Al3+与OH-不能大量共存;AlO2-与H+不能大量共存;Al3+与AlO2-、S2-、Hs-、CO3^2-、HCO3-(水解显碱性)因发生完全双水解而不能大量共存。
二、氢氧化铝具有两性的原因分析
当加入强酸,H+与OH-结合成水,使C(OH-)减小,平衡向碱式电离方式移动溶于强酸;当加入强碱时,OH-与H+结合成水,使(H+)减小平衡向酸式电离方向移动,故溶于强碱。
三、氢氧化铝的制备
从上式看出,有三种方法制出氢氧化铝:(1)铝盐(Al3+)与碱(OH-);(2)偏铝酸盐(AlO2-)与酸(H+);(3)铝盐(Al3+)与偏铝酸盐(AlO2-)。而实际上实验室可用:AlCl3加足量氨水;NaAlO2加足量CO3;AlCl3与NaAlO2按物质的量1:3之比混合制得。
四、可解决反应用量问题
如AL(OH)3是三元弱碱,故与酸反应式:nAl(OH)3:nH=1:3;Al(OH)3+3H+=AP3++3H2O
氢氧化铝又相当于一元弱酸,故溶于碱时nAl(OH)3:nOH-=1:1;Al(OH)3+OH-=AlO3+2H2O
当Al3+与AlO2-反应制Al(OH)3时,又可依据电荷守恒nAl3+:nAlO2-=1:3 Al3++3 AlO2-+6H2O=4Al(OH)3↓
五、可解决反应图像问题
如NaAlO3溶液加足量HCl和AlCl3溶液中加足量NaOH图像都为峰状,但最高点出现位置不同;前者在四分之一处,后者在四分之三处。而铝盐与偏铝酸盐的反应图像都为“厂”字图,只因氢氧化铝不溶两种盐之故也。
淄博铖博新材料有限公司
联系人:袁经理
电话:0533-6723166
传真:0533-6723166
手机:13853366558
邮箱:3039668148@163.com
地址:淄博市张店区张南路121号


